您现在的位置是:首页 > 生活 > 正文
潜在的阿尔茨海默病治疗将使用高频太赫兹辐射
发布时间:2023-08-08 16:33:31编辑:安琛蝶来源:
淀粉样蛋白沉积是阿尔茨海默病(AD)和帕金森病(PD)等神经退行性疾病的标志。沉积过程被描述为 S 形曲线,其中错误折叠的蛋白质在原纤维伸长之前组装成寡聚物。这一动态过程伴随着错误折叠的单体,更多的α-螺旋形成丰富的交联β-折叠结构。针对毒性积累可能是减缓或预防疾病发生的一种有前景的策略。
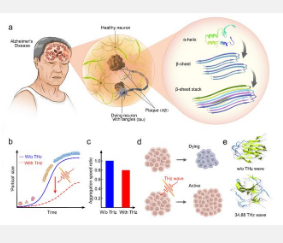
在《eLight》杂志上发表的一篇新论文中,北京大学张超教授领导的科学家团队开发了一种独特的技术,利用特定频率来调节和最大程度地减少淀粉样蛋白沉积的发展。
2018年有人推测生物神经信号的物理场可能是从太赫兹(THz)到红外(IR)范围的高频电磁场。它的范围很可能是 0.5 到 100 THz,被命名为广义太赫兹电磁 (EM) 波。一些生理过程已被证明,例如DNA发夹的解旋、电压门控钙通道的通透性和电压门控K+的电流可以对其进行调节。该机制揭示了太赫兹波与分子群共振并改变其中形成的氢键(H键)。此外,据报道,平行于原纤维轴的分子间氢键网络是引导淀粉样原纤维的关键。
受这些启发,如果可以利用共振特征来调节自组装过程并避免不需要的蛋白质聚集,那么对于预防或减轻 AD 病理学至关重要。早期的研究通过自由电子激光实验和分子动力学(MD)模拟方法联合发现,1675cm -1 (50.25 THz)的光可以解离淀粉样原纤维。由于生物液体在45-52.5 THz范围内有很强的吸收,因此在此频率上存在显着的热效应。它导致生理环境的调节效率必然大大减弱。因此,探索非热且高效的方法来抑制Aβ聚集过程迫在眉睫。
研究团队以β淀粉样蛋白(Aβ)为例进行研究。它并没有声称Aβ在AD发展中起决定性作用,因此越来越多的研究开始强调tau蛋白的重要性。淀粉样蛋白具有类似的动态聚集过程。目前尚无有效药物可以抑制或缓解AD病理恶化。
该研究旨在通过光学手段干预动态过程来调节病理蛋白的构象。这项基于Aβ的研究可能会进一步应用于tau蛋白,这对于开发联合疗法具有重要意义。
研究团队使用中心频率为34.88 THz(8.6 µm)的量子级联激光器(QCL)照射Aβ1-42低聚物。他们通过硫黄素 T (ThT) 结合测定和傅里叶变换红外 (FTIR) 光谱仪监测纤维化过程。研究小组发现,与没有外场的组相比,纤维化过程明显减慢。通过细胞活力和线粒体膜电位测定也检测到了该频率在细胞水平上的安全性。
可见细胞增殖明显,线粒体膜电位略有升高。它表明太赫兹波可能对细胞的功能产生积极影响。研究小组还发现蛋白质构象发生了显着变化,从规则有序结构变为无序结构,具体来说,更多的β-折叠结构转变为卷曲和弯曲区域。太赫兹波可能是延迟淀粉样纤维颤动过程的一种有前途的策略。
标签:
猜你喜欢
- 绷的多音字是什么意思(绷的多音字是什么)
- 微笑照片大全图片(微笑照片)
- 异性相吸同性相斥原理(异性相吸)
- 王奕盛打狗棍演的谁(王奕盛)
- 南极冰盖融化的影响(若南极冰盖完全融化地球海平面将上升)
- 通达信快捷键大全图片(通达信快捷键大全)
- 尺度最大的美剧是哪一部小说(尺度最大的美剧是哪一部)
- 找不到金税盘怎么解决(找不到金税盘)
- 开皇律是谁颁布的(开皇律)
- 主导的意思是(主导的意思)
- 二流子比喻什么人(二流子)
- 记忆棉是什么材质(记忆棉是什么)
- 企业安全生产的目的是什么(企业安全生产的重要意义)
- 厦门大学嘉庚学院好不好?(厦门大学嘉庚学院好不好)
- 余姚市梦麟中学2024年高考成绩(余姚市梦麟中学)
- 最好听的十首英语歌曲(最好听的英语歌曲排行榜)
- 适合手机铃声的歌曲纯音乐(适合手机铃声的歌曲)
- 三无人员是指哪三无(三无产品是指哪三无)
- 印度人口密度有多恐怖(印度人口密度)
- 苏州高铁站和苏州北站是一个地方吗(苏州高铁站)
